Was sind die arzneimittelrechtlichen Rahmenbedingungen für Spital-Apotheken?
Auch wenn die pharmazeutische Industrie ein breites Arzneimittelspektrum zur Verfügung stellt, gibt es immer noch für die Therapie dringend benötigte Pharmazeutika, die aus Gründen kurzer Haltbarkeit oder mangelnder Rentabilität auf dem Pharmamakrt fehlen. Ebenso erfordern individuell an den Patienten angepasste Medikamente sowie die Produktion von Studienmaterialien neben einem hohen Fachwissen auch flexible Produktionseinrichtungen, die die aktuellen Qualitätsstandards erfüllen. Spital-Apotheken, wie die Spital-Pharmazie des Universitätsspitals Basel, welches circa 1900 Betten versorgt, verfügen über ein Qualitätssystem, welches neben den Anforderungen des Schweizer Arzneibuchs auch die hohen GMP-Standards («Good Manufacturing Practice») der PIC/S abdeckt. Während sie dabei den identischen Regularien wie die pharmazeutische Industrie unterworfen sind, müssen sie diese mit einer weit geringeren Personaldecke gewährleisten. Daher ist es wichtig, dass alle Abläufe unter Einsatz von Lean-Werkzeugen hinsichtlich maximaler Effizienz optimiert werden.
Was versteht man unter mikrobiologischem Monitoring?
Das mikrobiologische Monitoring ermöglicht über die Bemusterung von Flächen der Produktionsräume, der Produktionsanlagen, Kleidung und Handschuhe der Mitarbeitenden sowie der Bestimmung des Keimstatus der Luft eine Aussage über den mikrobiellen Status der Herstelleinheit und damit über die Wirksamkeit der qualitätssichernden Massnahmen. Wöchentlich werden mehr als 200 Messpunkte mittels Agarplatten beprobt, diese auf zwei Temperaturstufen über mehrere Tage bebrütet, und dann jeweils die Keimzahlen von Bakterien- beziehungsweise Pilzkolonien ausgezählt und erfasst, was das Datenvolumen auf 800 Einzelwerte anwachsen lässt.
Wie sah der bisherige Prozess aus?
Die bisher eingesetzte Papier-Dokumentation war aufgrund der Datenfülle sehr personalintensiv und fehleranfällig. Neben dem hohen zu archivierenden Volumen konnte eine elektronische Auswertung nur ermöglicht werden, indem die Angaben manuell in eine MS-Access-Datenbank übertragen wurden. Mögliche Übertragungsfehler führten dabei zu Fehlinterpretationen.
Was waren die Projektziele?
Aufgrund des dringenden Handlungsbedarfs erfolgte gemeinsam mit den Abteilungen Herstellung, Qualitätssicherung und Informatik die Formulierung eines Lean-Projektes mit dem Ziel, die Datenqualität im Sinne der Produkt- und Patientensicherheit zu erhöhen, die Mitarbeiterzufriedenheit zu steigern und die für den Prozess benötigte Personalkapazität um mindestens 10–20 Prozent zu reduzieren.
Wie wurde in der Analysephase des Projekts vorgegangen?
Ausgangspunkt der Analysephase bildete die Darstellung des Papierprozesses und die Strukturierung aller Einflussfaktoren in einer Fischgrätendarstellung. Auch Aspekte, die aus einer Marktanalyse hinsichtlich verfügbarer technischer Lösungen ermittelt wurden, flossen in diese Betrachtungen ein. Daran schloss sich eine Gewichtung der Parameter in prozessspezifischen Prioritätsmatrizen und eine Wertung im Rahmen einer Nutzwertanalyse an. Um zusätzlich die Einflussmöglichkeiten auf die Prozessfaktoren zu bestimmen – was letztendlich auch einen Indikator für die Beherrschbarkeit darstellt – führte das Team noch eine FMEA-Risikoanalyse durch.
Wie sieht der neue elektronische Prozess aus?
Im Rahmen der Lean-Improve-Phase konnte der definitive Prozess eingeführt werden, der auf dem Einsatz eines für die Pharmaindustrie ausgelegten Softwarepakets in Verbindung mit einem auf die Bedürfnisse einer Spital-Apotheke optimierten Ablaufprozederes bestand. Zentrale Komponente des Systems stellt eine SQL-Datenbank dar, die die Daten mit einer auf einem virtuellen Server installierten Applikation und zwei Taschencomputern, sogenannten PDAs («Personal Digital Assistant»), synchronisiert. Während die auf den Server zugreifenden Clients eher für die Dateneingaben und die kalenderbasierte Terminierung der Bemusterungsaktivitäten ausserhalb der Produktionszonen verwendet werden, begleiten die PDAs die Mitarbeitenden in die Reinräume. Ihr lokales Betriebssystem (Windows CE oder Android) steht mittels WLAN mit der Datenbank in Verbindung und gleicht die Werte im Online-Modus ab.
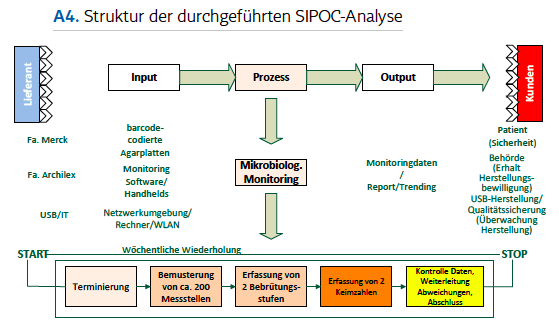
Kernstück des EDV-Systems ist die Codierung aller Probenahmestellen, Anlagen und Medien mit individuellen Matrix-Codes. Der Mitarbeitende wird zusammen mit den auf dem Bildschirm des PDA angezeigten Listen durch den Prozess geführt, ohne eine manuelle Eingabe vornehmen zu müssen. Die Elemente durchlaufen eine Korrektheitsüberprüfung, welche Abweichungen sofort signalisiert. Prozesszeiten, wie die des Bebrütungsprozesses der Agarmedien, unterliegen einer zeitlichen Überwachung. Die ermittelten Keimzahlen geben die Mitarbeitenden ebenso direkt in die Eingabemasken ein, genauso wie die Ergebnisse der bei einer Überschreitung der Grenzwerte durch ein externes Labor durchgeführten Keimdifferenzierung. Über die Reporting-Funktion der Applikation kann im Sinne der Patientensicherheit ein negativer Trend des Keimzahlniveaus rechtzeitig erkannt und korrigierende Massnahmen ergriffen werden. Um alle Ein- und Ausgangsgrössen und deren Auswirkungen auf den Prozess und dessen einzelne Module graphisch darzustellen, wurde vor dem Ausrollen der Anwendung noch eine SIPOC-Analyse durchgeführt.
Wie wurde das Erreichen der Projektziele nachgewiesen?
Die Lean-Control-Phase startete mit der erfolgreichen Durchführung der Softwarevalidierung, die sich in drei wesentliche Phasen unterteilte. Im Rahmen der Design- und Installationsqualifizierung musste bewiesen werden, dass die Software die GMP-Anforderungen erfüllt und korrekt in der Systemumgebung installiert wurde. Die Funktionsqualifizierung hatte darzulegen, dass alle vom Benutzer geforderten Funktionen einwandfrei arbeiten. Dafür erfolgte ein intensiver Test aller Bedienelemente, der Menüstrukturen und weitere Funktionen. Im Rahmen der Leistungsqualifi zierung zeigte das Programmpaket, dass es den harten Herausforderungen des Routinebetriebs gerecht wird.
Alle zu Projektbeginn angestrebten Ziele wurden vollumfänglich erreicht. Sowohl die Einsparung der Personalkapazität im Rahmen von 0,16 FTE konnte erreicht werden, was einem Betrag von 26 500 Franken pro Jahr entspricht und sich in den Budget- und Leistungszahlen der Abteilung abbildete, als auch der Nachweis einer hohen Mitarbeiterzufriedenheit, die in mehreren Mitarbeiterbefragungen bestätigt wurde. Die Datenqualität hatte sich durch die Direkteingabe der Daten und die vom Programm verifizierten Eingabeprozedere wesentlich verbessert. Eine zusätzliche Vier-Augen-Kontrolle mit elektronischer Unterschrift durch zwei Personen trägt ebenfalls dazu bei.
Und wo lagen die Herausforderungen?
Im Rahmen eines sehr effizienten Lean-Projekts konnte ein eigentlich für die Pharmaindustrie ausgelegtes Softwaremodul mit englischem Sprachpaket erfolgreich an die Anforderungen einer Spitalapotheke angepasst und damit die Zielvorgaben vollumfänglich erfüllt werden. Dies erforderte extrem motivierte Mitarbeitende und die Bereitschaft, den Prozess so zu modifizieren, dass eine optimale EDV-unterstützte Abarbeitung gewährleistet ist. Dabei waren auch EDV-Probleme zu lösen, die dem pharmazeutischen Personal einige Kreativität abverlangten. Als Ergebnis können gegenüber der alten Papierversion ein geringerer Personalbedarf und eine wesentlich bessere Datentransparenz und Qualität ausgewiesen werden. Die Mitarbeitenden der Herstellung, die zu Projektbeginn dem Projekt eher kritisch gegenüberstanden, sind heute uneingeschränkt von dem neuen Ablauf überzeugt.
Dr. Uli Lösch ist Leiter der Herstellung der Spital-Pharmazie des Universitätsspitals Basel. Nach dem Pharmaziestudium und Promotion in Mikrobiologie arbeitete er über 15 Jahre in unterschiedlichen Positionen der Pharmaindustrie, bevor er in die Spital-Pharmazie wechselte.
Dr. Stefanie Deuster ist Leiterin Qualitätssicherung in der Spital-Pharmazie des Universitätsspitals Basel. Nach dem Pharmaziestudium und der Promotion in Pharmakologie arbeitete sie in Spitalapotheken in Deutschland und in der Schweiz mit den Schwerpunkten Arzneimitt elinformation, Herstellung und Qualitätssicherung.
Sarah Niederberger ist Expertin für Patientenzentriertes Management im Universitätsspital Basel. Sie hat Internationale Beziehungen und Sozioökonomie an der Universität Genf studiert. Seit 2017 arbeitet sie in der Abteilung Patientenzentriertes Management.
BioFach
Weltleitmesse für Bio-Lebensmittel
Datum: 10.-13. Februar 2026
Ort: Nürnberg (D)